
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
بوسوتينيب كاس 380843-75-4
2023-08-21
الاسم الكيميائي:
4- (2،4-ثنائي كلورو-5-ميثوكسيانيلينو)-6-ميثوكسي-7-[3-(4-ميثيلبيبرازين-1-ييل)بروبوكسي]كينولين-3-كربونيتريل
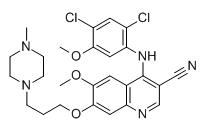
م.ف:C26H29Cl2N5O3
الخواص الكيميائية :أصفر شاحب صلب
Bosutinib هو مثبط كيناز Bcr-Abl لعلاج سرطان الدم النقوي المزمن الإيجابي لكروموسوم فيلادلفيا (Ph+). بالمقارنة مع مثبطات التيروزين كيناز الأخرى، فهو يتمتع بمظهر سمية دموية أكثر ملاءمة. تمت الموافقة عليه من قبل إدارة الغذاء والدواء الأمريكية في 4 سبتمبر 2012.
مبتكر:شركة وايث للأدوية (فايزر) (الولايات المتحدة)
التطبيقات:
وقد لوحظت التأثيرات على مورفولوجيا الخلية بتركيز 1 ميكرومتر SKI-606 لجميع خطوط الخلايا التي تم فحصها، وكانت التغيرات المورفولوجية واضحة عند تركيزات منخفضة تصل إلى 0.25 ميكرومتر. تسبب SKI-606 في التصاق الخلايا ببعضها البعض، وتشكيل مجموعات كثيفة مقارنة بالخلايا المعالجة بالتحكم في المركبات (DMSO)، والتي أظهرت انتشارًا على مساحات أكبر.
الشكل الصيدلاني: تناول عن طريق الفم، 100 ملغم/كغم/يوم، لمدة 28 يوماً
وسيطة:
CAS رقم 2031-23-4 1-(3-كلوروبروبيل)-4-ميثيلبيبرازين ثنائي هيدروكلوريد
CAS رقم 214470-66-3 7-(3-كلوروبروبوكسي)-4-هيدروكسي-6-ميثوكسيكينولين-3-كربونيتريل
رقم سجل المستخلصات الكيميائية 214470-68-5 4-كلورو-7-(3-كلورو-بروبوكسي)-6-ميثوكسي-كوينولين-3-كاربونيتريل
CAS رقم 263149-10-6 4-كلورو-7-هيدروكسي-6-ميثوكسي-كوينولين-3-كاربونيتريل
CAS رقم 380844-49-5 7-(3-كلورو-بروبوكسي)-4-(2,4-ديكلورو-5-ميثوكسي-فينيل أمينو)-6-ميثوكسي-كوينولين-3-كاربونيتريل
تمت الموافقة على الدواء المستهدف Bsutinib (Bosulif) من قبل إدارة الغذاء والدواء (FDA) لعلاج سرطان الدم النقوي المزمن. Besutinib هو مثبط كيناز يمنع مسارات إشارات Abl وSrc. يهدف هذا الدواء إلى علاج المرضى البالغين المصابين بسرطان الدم النخاعي المزمن المزمن أو المتسارع أو الحاد الذين لديهم كروموسوم فيلادلفيا إيجابي (Ph+) والذين لديهم مقاومة سابقة للأدوية أو عدم تحملها، وفقًا لإعلان شركة فايزر للأورام. وقالت شركة فايزر إن حوالي ثلث مرضى سرطان الدم النخاعي المزمن لا يستجيبون بشكل جيد للعلاج باستخدام عقار الخط الأول القياسي جليفيك. وقالت الشركة إن حوالي نصف المرضى الذين يصابون بمقاومة أو عدم تحمل للإيماتينيب يستجيبون بشكل سيئ أيضًا لمثبطات التيروزين كيناز الأخرى من الخط الثاني (TKI).
استندت الموافقة على الدواء عن طريق الفم في المقام الأول إلى التجارب السريرية للمرحلتين الأولى والثانية التي شملت 500 مريض CML إيجابي الرقم الهيدروجيني والذين لم يستجيبوا أو لا يتحملوا إيماتينيب، بما في ذلك مجموعات مختلفة في المراحل المزمنة والمتسارعة والحادة. وفقًا لبيانات التجارب السريرية لشركة Pfizer، حقق ثلث المرضى الذين عولجوا سابقًا باستخدام إيماتينيب وحده مغفرة وراثية خلوية كبيرة بعد 24 أسبوعًا من تناول بوسوتينيب (500 مجم مرة واحدة يوميًا). في المرضى الذين تلقوا إيماتينيب ومثبط آخر لتيروزين كيناز (داساتينيب، سبريسيل)، حقق 27٪ منهم مغفرة خلوية وراثية كبيرة. وقالت شركة فايزر إن معدلات الاستجابة استمرت في الارتفاع في كلا المجموعتين بعد 24 أسبوعًا أو أكثر من تناول الدواء. وتشير شركة فايزر إلى أن 4 بالمائة فقط من المرضى الذين يعانون من مرض مزمن يتقدمون إلى المرحلة المتقدمة أو الحادة بعد تناول دواء بيسوتينيب. تشمل الآثار الجانبية من الدرجة 3-4 قلة الصفيحات (26%)، قلة العدلات (11%)، الإسهال (9%)، فقر الدم (9%)، والطفح الجلدي (8%).
تم تطوير Bosutris (Bosutinib) bossutinib في الأصل بواسطة شركة Pfizer وتمت الموافقة عليه لأول مرة في الولايات المتحدة في سبتمبر 2012 لاستخدامه في البالغين الذين يعانون من Ph+CML والذين لديهم تاريخ سابق من المقاومة أو عدم تحمل العلاج في المراحل المزمنة أو المتسارعة أو الحادة. . BOSULIF هو أول دواء من شركة Pfizer لعلاج أورام الدم وهو خيار علاجي مهم لمرضى Ph + CML الذين لديهم مقاومة سابقة للأدوية أو عدم تحملها. هذا المؤشر الموسع لديه القدرة على أن يكون له تأثير أكبر على حياة المرضى الذين يعانون من سرطان الدم النقوي المزمن.
في 13 يوليو 2020، افتتحت شركة Mylan Pharmaceutical الهندية الإطلاق التجاري العام لـ Bosutinib (Bosutinib/Bosutinib/Bosutinib). تكلف النسخة العامة من عقار Mylan Bosutris حوالي 25% أقل من تكلفة عقار Bosulif الأصلي من شركة Pfizer. (أيضًا: ستندمج شركة Upjohn، ذراع الأدوية الجنيسة لشركة Pfizer، مع شركة Mylan هذا العام لإنشاء شركة Viatris، أكبر شركة للأدوية الجنيسة في العالم، والتي سيتم الانتهاء منها في الربع الأخير من عام 2020.)




