
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
جيلتريتينيب فومارات
2023-12-02
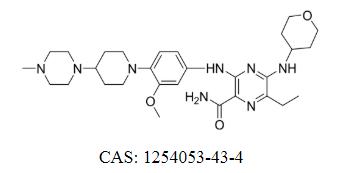
جيلتريتينيب فومارات كاس: 1254053-43-4
1. الخلفية
الأدوية المستهدفة لجيليت (جيلتيريتينيب) لمرضى سرطان الدم النخاعي الحاد تعيش لفترة أطول، وقد نشرت مؤخرًا بشكل أفضل في مجلة نيو إنجلاند الطبية لنتائج تجربة سريرية كبيرة تظهر أنه: مقارنة بالعلاج الكيميائي، فإن استخدام الأدوية المستهدفة لجيليت (جيلتيريتينيب، اسم السلعة) Xospata) ، يمكن أن يحسن بعض معدل البقاء على قيد الحياة للمرضى الذين يعانون من سرطان الدم النقوي الحاد (AML).
نتائج التجربة الجديدة مشجعة. كان المرضى الـ 371 المسجلون في التجربة مرضى سرطان الدم النخاعي الحاد (AML) الذين لديهم طفرة محددة في جين FLT3 الذين سبق علاجهم ولكنهم انتكسوا لاحقًا أو لم يستجيبوا للعلاج (متكرر/مقاوم). تم توزيعهم بشكل عشوائي إما على علاج جيلتريتينيب أو العلاج الكيميائي القياسي.
أظهرت النتائج أن المرضى الذين عولجوا لقبول جيليت، جيلتريتينيب لم يعيشوا لفترة أطول فقط من المرضى الذين يخضعون للعلاج الكيميائي (كان متوسط مدة البقاء الإجمالية 9.3 أشهر إلى 5.6 أشهر)، وكانوا أكثر عرضة لتحقيق مغفرة كاملة، وعودة عدد خلايا الدم البيضاء إلى المستوى الطبيعي. كليًا أو جزئيًا (المرضى الذين عولجوا بالجيلتيريتينيب (34٪)، 15٪) في المرضى الذين يخضعون للعلاج الكيميائي.
2. العرض
تمت الموافقة على Gilteritinib Fumarate، الذي طورته Astellas، من قبل الوكالة اليابانية للأجهزة والأجهزة الطبية الصيدلانية المتكاملة (PMDA) في 21 سبتمبر 2018، وتمت الموافقة عليه لاحقًا من قبل إدارة الغذاء والدواء الأمريكية (FDA) في 28 نوفمبر 2018، ومن قبل إدارة الأدوية الأوروبية (EMA) بتاريخ 24 أكتوبر 2019 تحت الاسم التجاري Xospata®. حصل Gilteritinib على حالة الدواء السريع واليتيم من إدارة الغذاء والدواء.
Gilteritinib Fumarate هو مثبط FLT3/AXL وتمت الموافقة على Xospata® لعلاج سرطان الدم النخاعي الحاد المتكرر أو المقاوم مع طفرة FLT3 الإيجابية.
Xospata® هو قرص فموي يحتوي على 40 ملغ من جيلتيريتينيب. الجرعة الموصى بها هي 120 ملغ مرة واحدة في اليوم. يمكن زيادة الجرعة أو تقليلها حسب حالة المريض، ولكن يجب ألا تتجاوز 200 ملغ في اليوم.
3. مكان الهدف
أكسل؛ FLT3
4. آلية العمل
مثبطات مستقبلات AXL؛ مثبطات FLT3
5. المؤشرات
سرطان الدم النقوي الحاد
6. مرحلة التطوير
تمت الموافقة على التسويق في 21 سبتمبر 2018
7. شركة البحث والتطوير
النجم
8. طريق التوليف
8.1. الطريق الأصلي
8.2. طريقنا (الأمثل) - استقرار أفضل وعائد أعلى
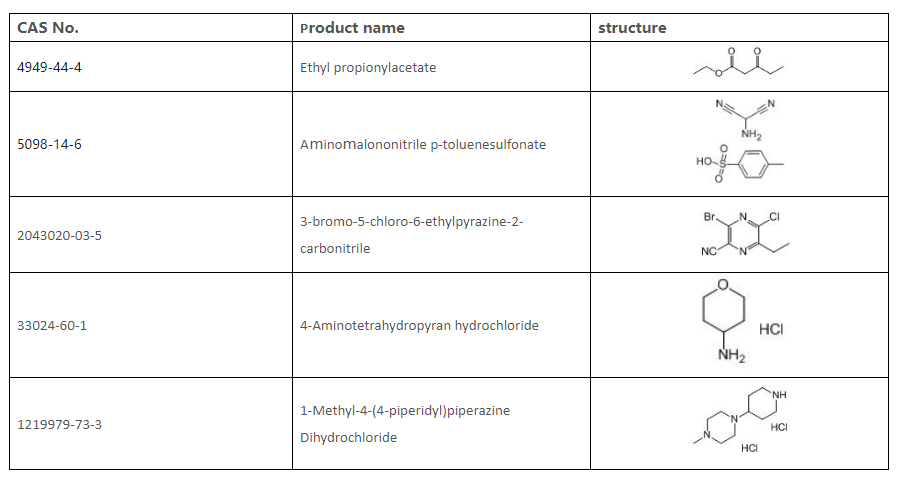
8.3. روس خالد شيخ محمد [CAS 2043020-03-5]
8.4. عملية تصنيع موجزة [CAS 2043020-03-5]
الخطوة 1:
إلى معلق NaOH تمت إضافة إيثيل 3-أوكسوبنتانوات في جزء واحد، وبعد ذلك تم تقليب خليط التفاعل عند درجة حرارة الغرفة. تمت إضافة محلول NaNO2 إلى الماء، ثم إضافة H2SO4 قطرة قطرة. تمت إضافة محلول NaOH قطرة قطرة، وتم استخلاص الخليط الناتج باستخدام MTBE. تم غسل الطبقات العضوية المجمعة باستخدام محلول ملحي، وتجفيفها فوق Na2SO4، وترشيحها وتركيزها لإعطاء المنتج (E)-2-أوكسوبوتانال أوكسيم.
الخطوة 2:
تم تقليب معلق (E) -2-oxobutanal oxime وAminomalononitrile p-Toluenesulfonic Acid في IPA) عند درجة حرارة الغرفة تحت الأرجون. بعد فحصه بواسطة TLC، تم ترشيح خليط التفاعل، وتم غسل الكعكة باستخدام IPA وماء، وتجفيفها للحصول على 2-أمينو-3-سيانو-5-إيثيلبيرازين 1-أكسيد.
الخطوه 3:
إلى معلق 2-أمينو-3-سيانو-5-إيثيلبيرازين 1-أكسيد في DMF اللامائي تمت إضافة POCl3 عند 0 درجة مئوية. تم تقليب الخليط الناتج عند 80 درجة مئوية. بعد فحصه بواسطة TLC، تمت إضافة خليط التفاعل إلى ثلج/ماء ببطء وتم استخلاصه باستخدام MTBE. تم غسل الطبقات العضوية المجمعة باستخدام محلول ملحي، وتجفيفها فوق Na2SO4، وترشيحها وتركيزها لإنتاج 3-أمينو-5-كلورو-6-إيثيلبيرازين-2-كربونيتريل.
الخطوة 4:
إلى تعليق t-BuONO وCuBr2 في DMF تمت إضافة محلول 3-amino-5-كلورو-6-إيثيلبيرازين-2-كربونيتريل في DMF قطرة قطرة. بعد فحصه بواسطة TLC، تم تبريد خليط التفاعل إلى درجة حرارة الغرفة، ثم صبه في ثلج/ماء، واستخلاصه باستخدام MTBE. تم غسل الطبقات العضوية المجمعة باستخدام محلول ملحي، وتجفيفها فوق Na2SO4، وترشيحها وتركيزها لإعطاء خام تم تنقيته بواسطة تحليل كروماتوجرافي ليعطي 3-برومو-5-كلورو-6-إيثيلبيرازين-2-كربونيتريل.
9. قائمة المواد الوسيطة التي يمكننا توريدها
Sandoo Pharmaceutica هي شركة متخصصة في تصنيع المواد الوسيطة الصيدلانية. نحن نقدم نوعية جيدة Gilteritinib Fumarate Cas: 1254053-43-4. مرحبا بكم ونحن نتطلع إلى سؤالكم!




